在线客服


ISO13485 医疗器械质量管理体系——做放心的医疗器械
ISO13485旨在在全球范围内促进用于质量管理体系的适当法规要求的协调一致,该体系应用于涉及医疗器械生命周期一个或多个阶段的组织,是一个独立标准,仅供医疗器械行业的组织内部使用,也可用于合同或认证目的,专业性强是其显著特点。其对产品标识、过程控制、监督管理等方面的控制要求更加严格,可以帮助您的产品自由进入全球市场。
通过ISO13485认证,企业可以:
提高和改善企业的管理水平,提高企业的知名度;
提高和保证产品的质量,使企业获取更大的经济效益;
有利于消除贸易壁垒,取得进入国际市场的通行证,有利于增强产品的竞争力,提高产品的市场占有率。
1. 适用于涉及医疗器械生命周期的一个或多少阶段,包括医疗器械的设计和开发、生产、储存和经销、安装或维护和相关活动(例如技术支持)的设计和开发或提供。也可用于向这类组织提供产品(包括与质量管理体系相关的服务)的供方或外部方。
2. 体系运行不少于3个月;
3. 要求获得ISO13485认证注册的公司,必须具备有至少连续3个月的管理体系记录,包括内部评审和管理评审的完整记录。
1. 合同
2. 申请书
3. 营业执照和组织机构代码证(确认在有效期内)
4. 其他有效的资质证明(产品生产许可证等,适用时)
5. 企业简介
6. 组织架构图
7. 产品工艺流程图
8. 产品说明书(适用时,如:最终产品需提供);
9. 适用的法律法规清单,包括产品标准清单(适用时,如:最终产品需提供);
10. 近期国家、行业产品/服务监督抽查报告(如发生);
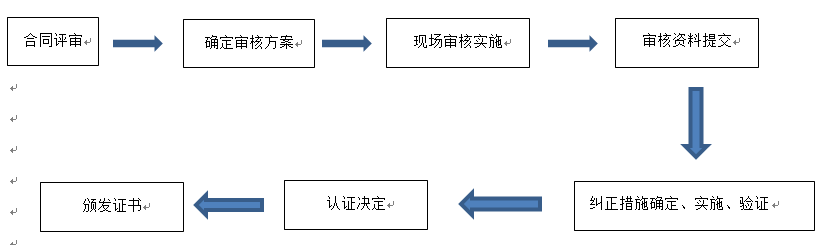
合同签定之日起30日内由甲方支付给乙方初次审核的全部费用的50%,审核费的剩余部分应在现场审核前一次付清;甲方申请再认证审核时,应一次性支付再认证审核费;
监督和再认证的审核费用应在每次审核60日前一次付清。









Q:企业所生产的产品不属于医疗器械及其组件,是否可以申请ISO13485认证?
A:按照ISO13485标准,ISO13485适用于涉及医疗器械生命周期的一个或多少阶段,包括医疗器械的设计和开发、生产、储存和经销、安装或维护和相关活动(例如技术支持)的设计和开发或提供。也可用于向这类组织提供产品(包括与质量管理体系相关的服务)的供方或外部方。
Q:企业获得证书后,能够在哪里查询证书的有效性?
A:认证认可业务信息统一查询平台:http://cx.cnca.cn/rjwcx/web/cert/index.do?progId=1212
SNQA网址:http://www.snqa.com.cn
 沪公网安备 31011502012663号
Copyright © 2016 snqa.com.cn All rights reserved. 版权所有:上海恩可埃认证有限公司 沪ICP备05008057号
沪公网安备 31011502012663号
Copyright © 2016 snqa.com.cn All rights reserved. 版权所有:上海恩可埃认证有限公司 沪ICP备05008057号
